Profesionales
EPISODIO II
Investigador ecuatoriano descubre el mecanismo por el cual las bacterias pierden su resistencia a los antibióticos
Ahora el estudio pasó a una fase preclínica y los resultados estarían a mediados de año
Lunes, 11 de enero de 2021, a las 14:12

Fernando Gordillo, investigador de la Universidad Monash, Australia. |
Cristina Coello. Quito
Fernando Gordillo Altamirano, investigador ecuatoriano de Microbiología de la Universidad Monash (Melbourne - Australia) ha descubierto un grupo de bacteriófagos (virus) capaces de alterar y eliminar bacterias resistentes a los antibióticos como la Acinetobacter baumannii (A. baumannii). Su estudio ha sido publicado en la revista ‘Nature Microbiology’ (link aquí).
Esa bacteria es uno los principales agentes que causan infecciones hospitalarias muy resistentes a los antibióticos a nivel mundial pero esta investigación puede ayudar a pacientes que sufren infecciones que no responden a tratamiento antibiótico.
En entrevista con EDICIÓN MÉDICA, Gordillo ha detallado que su investigación se enfocó en buscar un grupo de bacteriófagos capaces de alterar la bacteria y obligarla a perder su cápsula protectora, volviéndola así sensible a los antibióticos betalactámicos.
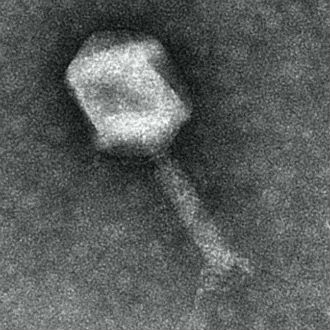
Bacteriófago FG02 |
“Al dejar de producir su cápsula, A. baumannii se vuelve sensible a antibióticos contra los que solía ser resistente. De 9 antibióticos que probamos, 7 resultaron ser efectivos. Antes no podíamos utilizar ninguno, pero cuando tenemos el bacteriófago de por medio, ahora lo podemos hacer”, ha resaltado.
Mientras una bacteria posea su capa o capsula protectora seguirá multiplicándose y haciendo daño. Para eliminarla, “el bacteriófago utiliza como puerta de entrada esa misma cápsula y como reacción la bacteria para evitar ser eliminada por el virus la desactiva. Es en ese lapso cuando se utiliza los antibióticos que solía resistir”.
Gordillo aseguró que la aplicación de los bacteriófagos o fagoterapia puede llegar a ser muy versátil en pacientes con diferentes tipos de infecciones resistentes (link aquí). Se los puede administrar de varias formas: por nebulización, intravenosa y hasta tópica.
Al ser consultado sobre su uso, ha explicado que, al detectarse una infección resistente, primero se realiza un cultivo para identificar la bacteria causante, mientras en el laboratorio se aísla bacteriófagos contra esa bacteria en particular.
Ya con los fagos efectivos y purificados se prepara una solución a muy altas concentraciones y se administra según lo requiera el paciente. “Por ejemplo, a uno con neumonía mediante nebulización, a otro con sepsis de forma intravenosa y en la unidad de quemados se puede aplicar de manera tópica directamente en la herida”, ha asegurado el científico.
Lo que sigue
Este estudio ya ha pasado a una fase preclínica cuyos resultados, según Gordillo, estarían a mediados de año. Mientras tanto anticipó que todo se ve “muy alentador. Después de eso el siguiente paso es llevar a estudios clínicos. Estamos muy optimistas”, ha comentado.
También ha asegurado que en todos los estudios con la aplicación de la fagoterapia no se ha detectado efectos adversos severos.
“Los bacteriófagos para seguir multiplicándose necesitan a la bacteria, una vez que matan a la bacteria se quedan sin un medio para seguir multiplicándose y simplemente son retirados por de nuestro sistema inmunológico. No generan reacciones adversas de tipo alérgico o anafiláctico, como si suele suceder con los antibióticos. Interactúan con las células de nuestro cuerpo, pero no las atacan, tienen un perfil de seguridad bastante bueno”, ha añadido.
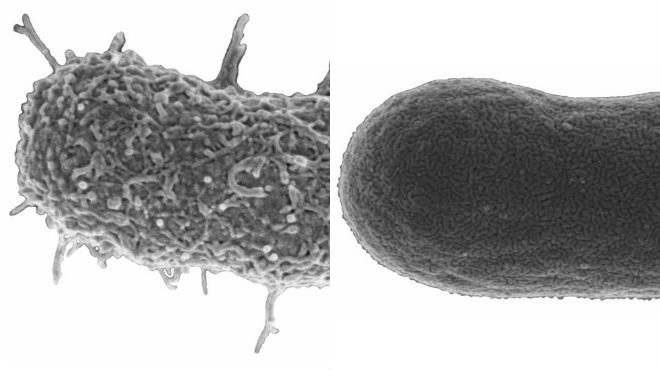
A la izquierda A. baumannii con cápsula y a la derecha sin ella. |