Profesionales
NUEVO TRATAMIENTO
La FDA autoriza el uso de anticuerpos sintéticos contra la CoVID19
El bamlanivimab imita lo que hace el sistema inmunitario tras el contagio
Martes, 10 de noviembre de 2020, a las 11:01
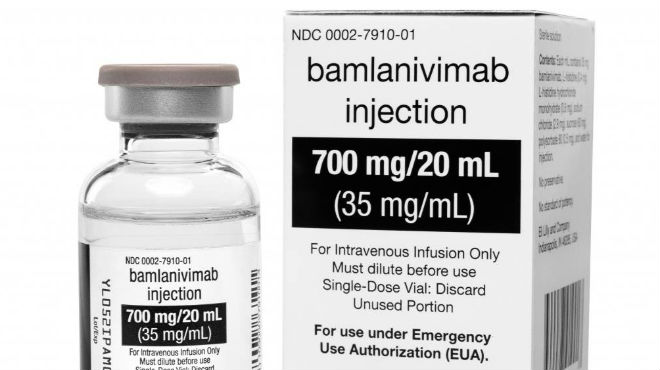
Solo para uso de emergencia. |
Redacción. Quito
La agencia reguladora de medicamentos de Estados Unidos (FDA) ha concedido una autorización temporal para un nuevo tipo de tratamiento contra la CoVID19, los anticuerpos sintéticos fabricados por la farmacéutica Eli Lilly, únicamente para los enfermos leves o moderados.
El tratamiento se ha desarrollado de forma específica contra el nuevo coronavirus. Otros, como el remdesivir y la dexametasona, también recibieron autorizaciones tras haber demostrado cierta eficacia contra el patógeno, pero sus moléculas ya existían antes de la pandemia y tenían otros usos.
La FDA ha dado una "autorización para un uso de emergencia" del nuevo tratamiento, basándose en los resultados de un ensayo clínico realizado con 465 adultos no hospitalizados.
La compañía estadounidense Eli Lilly había solicitado el visto bueno de la agencia reguladora hace poco más de un mes.
Los anticuerpos se podrán utilizar únicamente con adultos y jóvenes de más de 12 años, con un peso de al menos 40 kilogramos, y que tengan "un alto riesgo de evolucionar hacia un CoVID19 grave y/o una hospitalización".
El tratamiento llamado bamlanivimab se administra con una sola inyección intravenosa. Esos anticuerpos imitan lo que hace el sistema inmunitario tras el contagio por el coronavirus, bloqueando la punta del virus que le permite adherirse a las células humanas y penetrar en su interior.
Se considera que este tratamiento es más eficaz en la fase inicial de la infección, cuando los anticuerpos tienen todavía una posibilidad de detener el virus, y no durante la segunda fase del CoVID19, en la que el peligro ya no es el patógeno sino una reacción excesiva del sistema inmunitario, que ataca los pulmones y otros órganos.
En el ensayo clínico, sólo el 3 por ciento de los pacientes con alto riesgo de sufrir un CoVID19 grave tuvieron que ser hospitalizados o acudir a urgencias tras recibir bamlanivimab, frente al 10 por ciento al que se le administró un placebo.