

Paola Leone, SOLCA Quito. |
Redacción. Quito
Para el diagnóstico y seguimiento del mieloma múltiple (MM) según las guías americanas y europeas, los estudios genéticos se deben realizar sobre la muestra de células plasmáticas.
A pesar de que en Ecuador hay aproximadamente 25 citómetros de flujo, no había un solo equipo de separación celular, y los análisis genéticos se han realizado sobre la muestra total de médula ósea, la cual contiene diferentes tipos de células sanguíneas.
Cabe recordar que el MM es el tumor de las células plasmáticas, las cuales representan al linfocito B maduro.
El análisis de la muestra total de médula ósea ha permitido identificar alteraciones a nivel de citogenética convencional y de citogenética molecular, con FISH, ensayo cometa y cariotipo espectral, al igual que en estudios de biología molecular al comparar variantes genéticas presentes en el ADN de médula ósea frente al ADN de sangre periférica, como material genético constitucional.
Esto ha sido posible por el hecho de que los pacientes con MM llegan tarde a la consulta, la mayoría corresponden a estadio III, con alta infiltración de células plasmáticas y una enfermedad avanzada. A pesar de esta realidad, hay casos que son diagnosticados de forma temprana y los estudios genéticos no revelan los daños genéticos responsables de este tipo de cáncer.
En un estudio sobre la sensibilidad de detección de daño genético en España y lo mismo en Ecuador, ha mostrado que en España se detectaron 77 por ciento de alteraciones por citogenética convencional y 93 por ciento por FISH; en cambio en Ecuador, se evidenciaron 39 por ciento y 46 por ciento respectivamente. Las tecnologías eran las mismas y quien dirigía ambos grupos era la misma profesional, la diferencia radicaba en la muestra analizada. A continuación, el algoritmo de diagnóstico e investigación del MM (Figura 1).
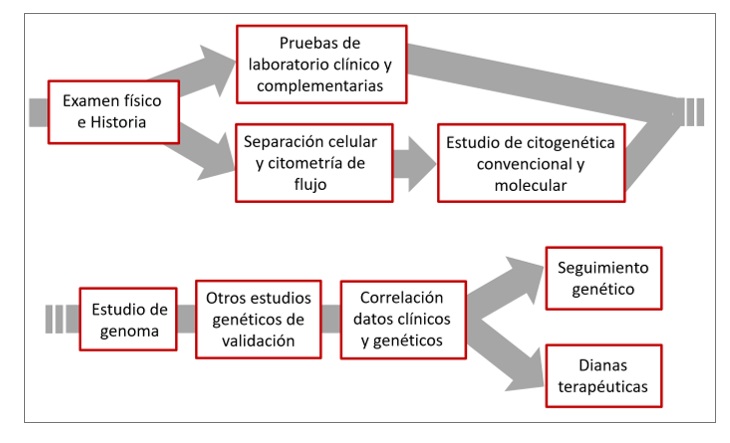
Figura 1. Algoritmo de diagnóstico e investigación del mieloma múltiple. |
Con el objetivo de mejorar la identificación de alteraciones genéticas que son importantes en la clasificación del MM desde el punto de vista genético, que están asociadas con el pronóstico, e influyen en la elegibilidad del paciente al trasplante, se ha iniciado el uso de un separador de células plasmáticas a través de perlas magnéticas en SOLCA de Quito.
Las células plasmáticas tienen en su membrana marcadores específicos y en este caso son el anticuerpo 138, CD138+. A partir de esta característica, el principio de separación del equipo se basa en perlas magnéticas que se unen a las células CD138+, luego la suspensión se coloca en el equipo que cuenta con un imán, así las células marcadas quedan adheridas al campo magnético y las células sin marcar son retiradas de la solución. Finalmente, las células CD138+ son eluídas y listas para emplear en cualquier estudio genético.
Las diferentes poblaciones celulares: muestra total, fracción negativa y fracción positiva CD138+, de sangre periférica y de médula ósea, se presentan a continuación por citometría de flujo (Figura 2).
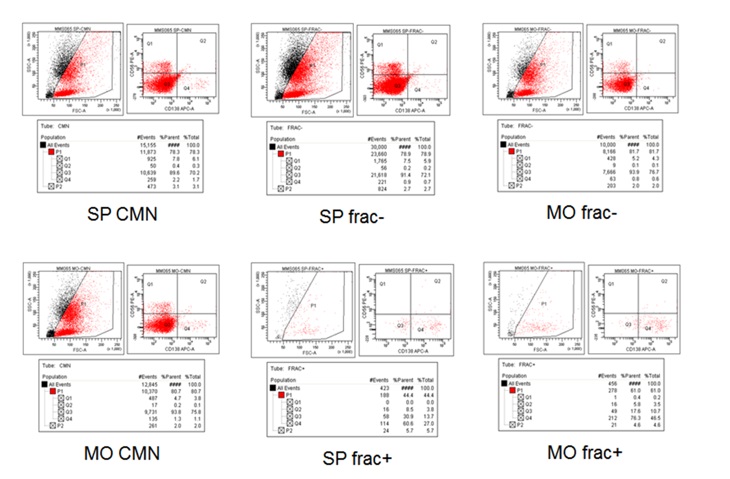
Figura 2: Citometría de flujo en muestra de mieloma múltiple estadio I. CMN, Muestra total de sangre periférica (SP) y de médula ósea (MO), fracción negativa (frac-) y fracción positiva (frac+). |
La fracción positiva CD138+ es muy pequeña con relación a la fracción negativa y a la muestra total de sangre periférica y de médula ósea, lo que influye en la detección de alteraciones genéticas presentes en esa población celular.
En cambio, en casos con alta infiltración que corresponden a un estadio III, la fracción positiva es notoria y aun partiendo de la muestra total de médula ósea se puede encontrar alteraciones genéticas (Figura 3).
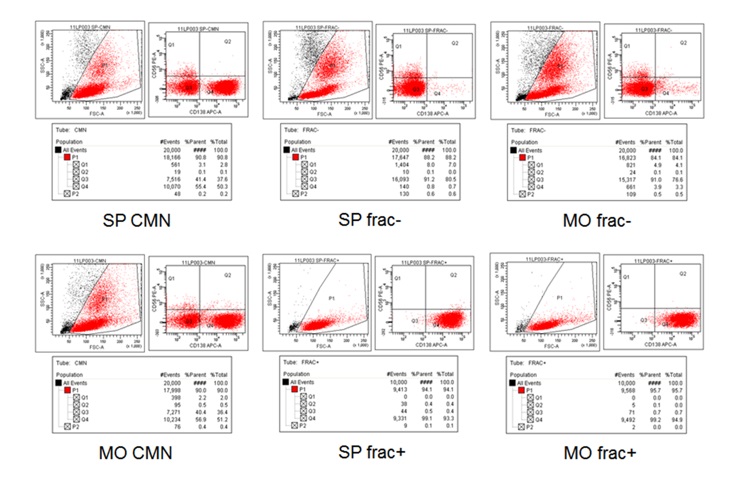
Figura 3. Citometría de flujo en muestra de mieloma múltiple estadio III. CMN, Muestra total de sangre periférica (SP) y de médula ósea (MO), fracción negativa (frac-) y fracción positiva (frac+). |
Las perlas magnéticas van a seleccionar todas las células plasmáticas CD138+, tanto normales como tumorales, pero es una población específica en la cual la caracterización de los daños genéticas será más dirigida. Además, se pueden hacer separaciones subsiguientes hasta obtener solo la población tumoral. Las células plasmáticas normales son CD19+ y CD56-, mientras las células de mieloma son CD19- y CD56+.
Con el separador celular se hizo un análisis de casos, tanto con la muestra total de médula ósea como con la muestra de células plasmáticas CD138+. Realizaron un cariotipo y FISH, y obtuvieron un aumento en la detección de alteraciones genéticas: 34 por ciento por citogenética convencional y 54 por ciento por FISH en la muestra separada.
La aplicación de paneles de FISH se realizó en el siguiente orden: Primer panel: 1p/1q, RB, IGH y TP53.
Según el resultado de IGH, si está translocado, se buscará el partner con las siguientes sondas: Segundo panel: t(4;14), t(11;14), t(14;16) y t(14;20)
En casos de investigación, según los resultados anteriores, se puede utilizar las siguientes sondas: Tercer panel: t(6;14) y t(8;14)
A continuación, una imagen de FISH en muestras de médula ósea y en muestra separada del mismo caso (Figura 4).
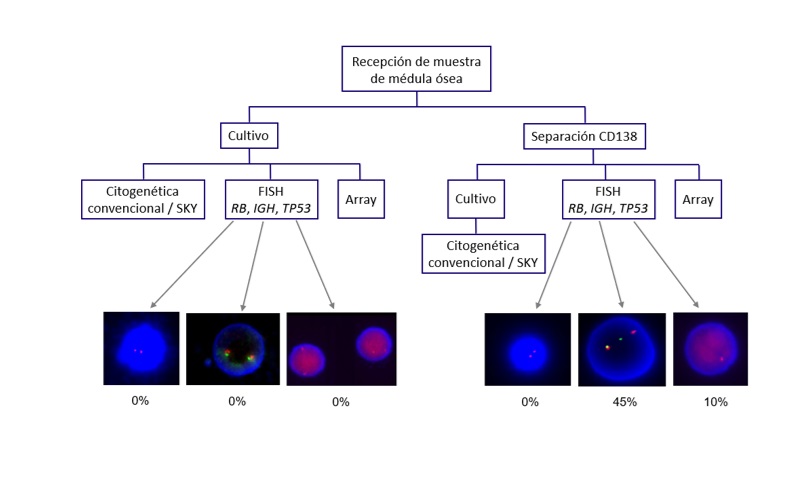
Figura 4: Comparación de resultados de FISH entre la muestra total de médula ósea y la muestra separada CD138. En la muestra separada se observó translocación del gen IGH y deleción del gen TP53. |
La separación de las células plasmáticas es un paso importante en el algoritmo de trabajo en mieloma múltiple, sea en la actividad asistencial como en la investigación.
La detección de alteraciones como ganancia de cromosomas, sobre todo de los impares, permite clasificar al MM en “MM hiperdiploide”, que está asociado a buen pronóstico; y la ausencia de hiperdiploidía y presencia de alteraciones estructurales, lo clasifica como “MM no hiperdiploide” y se presenta en casos de peor pronóstico. Según el tipo de partner del gen IGH se puede determinar la elegibilidad de un paciente al trasplante. Las alteraciones genéticas se asocian a distintos grados de riesgo (Figura 5). Los daños de riesgo alto e intermedio son los más frecuentes en los pacientes ecuatorianos.
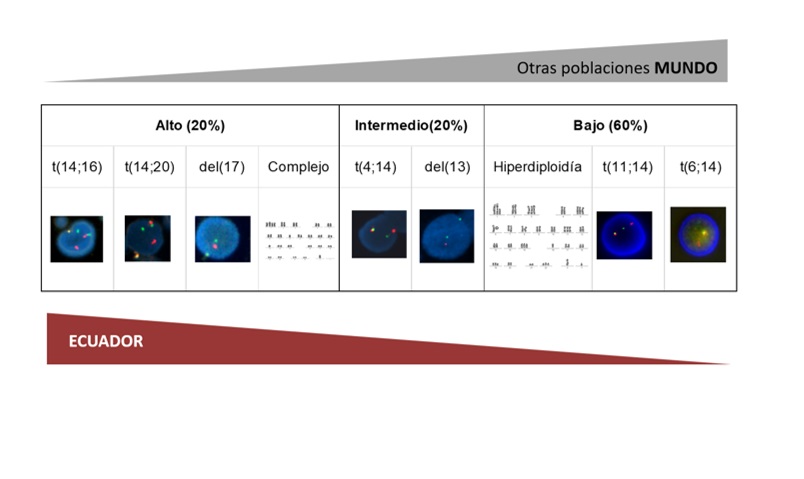
Figura 5. Alteraciones cromosómicas detectadas por citogenética convencional y molecular asociadas con el grado de riesgo. |
La separación de células plasmáticas es un proceso que se puede realizar con diferentes tecnologías como el separador magnético automatizado para varias muestras, hasta 100 muestras por kit y la cantidad de células puede variar entre 107 a 109 según el tipo de columna. El equipo manual es para una muestra por vez: 108 células por mililitro, aunque la tecnología tiene presentaciones para varias muestras, y al igual que el anterior tiene perlas magnéticas para diferentes tipos celulares. También hay otros tipos de obtención de células plasmáticas como el kit de Rosette, basado en la separación negativa.
La detección precisa de alteraciones genéticas requiere de la adecuada muestra para realizar los estudios genéticos y ya se cuenta con el separador de células plasmáticas en el país.
Referencias
1.- Leone PE (Editora). Mieloma múltiple en América. Edición de Red Iberoamericana de Investigación en Mieloma Múltiple, Sociedad Ecuatoriana de Genética Humana, Laboratorio de Genética-SOLCA, TAKEDA y Grupo PLM. 2022 Quito, Ecuador (Derechos de Autor No. QUI-061279, ISBN No. 978-9942-40-856-3).
2.- Leone PE, Montesdeoca B, Chiluiza D, Morales I, Sánchez ME, Buenano ME, Cevallos F, Espín VH, Ocampo L, Paz-y-Miño C. Datos de Ecuador en la Red Iberoamericana para la Investigación de Mieloma Múltiple. Revista Oncología. 2013; 23(1), 7-16.
3.- Catalina P, Palma C, Elosua C, Marín-Niebla A, Urbano-Ispizua A, Leone PE. Utilidad del empleo de otras técnicas citogenéticas en los casos de mieloma con cariotipo complejo de difícil caracterización. Haematologica (ed. Esp.). 2009; 94 (sup 1), PO-290.


















