
Profesionales
CAPNOGRAFÍA CAPNOSTREAM
Reporte de seguridad internacional sobre monitor portátil para oximetría de pulso
ARCSA recomienda a los profesionales de la salud que revisen si en sus instituciones se utiliza este dispositivo médico
Jueves, 06 de septiembre de 2018, a las 11:40
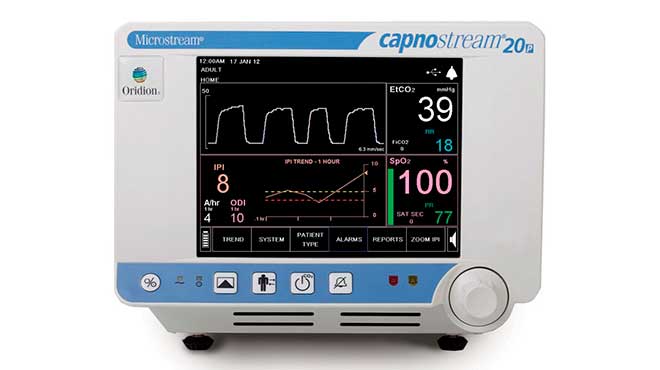
Podría conllevar a potenciales eventos o incidentes adversos sobre los pacientes. |
Redacción. Quito
La Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (ARCSA), a través del Centro Nacional de Farmacovigilancia, ha dado a conocer el reporte de seguridad del Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) de Colombia sobre el monitor portátil de mesa para oximetría de pulso ‘Capnografía Capnostream’.
De acuerdo a lo informado, el fabricante ha indicado que ha detectado la posibilidad de que la configuración de la hora y fecha, la llamada a enfermería y la configuración de la alarma de los equipos referenciados, regresen a la configuración de fábrica cuando el monitor se apaga.
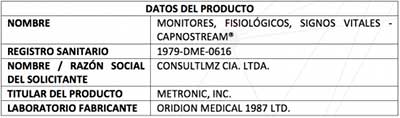
De esta manera está registrado el dispositivo médico en el país. |
Por este motivo, ARCSA ha recomendado a los profesionales de la salud que revisen si en sus instituciones se utiliza el dispositivo médico ‘Capnografía Capnostream’.
Además, ha solicitado que desde los programas institucionales de Tecnovigilancia se realice la búsqueda activa para la detección de los incidentes y eventos adversos que involucren el producto referenciado y se notifiquen a sus programas institucionales de Tecnovigilancia o a la autoridad competente, según corresponda.
Información para establecimientos de salud:
1. Verifique si en su institución se utilizan los dispositivos médicos involucrados.
2. Comuníquese con el importador, distribuidor o comercializador para precisar si existen recomendaciones específicas para la utilización del producto.
3. Reportar los incidentes y eventos adversos asociados a la utilización del dispositivo médico referenciado, al Centro Nacional de Farmacovigilancia.
Información para establecimientos farmacéuticos
1. Efectúe la trazabilidad del producto afectado y dé inicio al plan de acción dispuesto por el fabricante.
2. Reportar los incidentes y eventos adversos asociados a la utilización del dispositivo médico referenciado, al Centro Nacional de Farmacovigilancia.














